1.飼育水槽が汚れる原因
(アンモニアの生成)
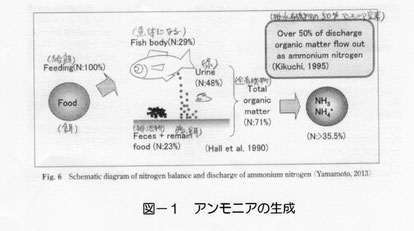
魚は、自分自身が生きていくためのエネルギーや自分の身体を大きくするために餌を食べます。魚の養殖業ではたくさん餌を与えて、できるだけ早く魚を大きくするかが、養殖の大きな目的になっています。食べた餌は、排泄物(糞や尿)として排泄することは生物共通の現象で人間も同じです。その排泄物は水槽の水の中に溶けだしますが、主な成分は餌に含まれていたタンパク質です。そのタンパク質は、水中やフィルターのいる細菌類に分解されて、一部はアンモニアに変化します。人間も同じで、排泄する尿にもたくさんのアンモニア(NH3 + NH4+)が含まれています。この排泄物の約50%はアンモニア性窒素で、又、与えた餌の約35%がアンモニア成分(NH3 + NH4+)として水中に溶け込みます(図-1)。水中に溶けたアンモニアのうちNH4+(解離アンモニウムイオン:イオンになっている)の毒性は高くないですが、NH3(非解離アンモニア:イオンになっていない)は、魚にたいする毒性が非常に高いといわれています。
2.アンモニアの硝化
(アンモニアの無毒化)
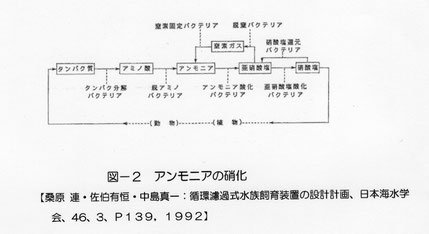
魚の排泄物に含まれるタンパク質がタンパク質分解細菌によりアミノ酸に分解され、脱アミノ細菌によりアンモニアになり、アンモニアは、まずアンモニア酸化細菌により亜硝酸性窒素にかわり、そののちに亜硝酸酸化細菌により硝酸に変わります(図―2)。自然界では生成された硝酸の一部は植物に吸収されたり、脱窒細菌により空気中に窒素ガスとして放出されます。飼育水槽では一部は水草に肥料として吸収されますがその量は少なく、ほとんどは水中に硝酸として残るので、それが原因で飼育水槽のpHが下がっていきます。

3.pHの低下
(硝化の進行)
pHがさがると魚にも影響がでてきますが、硝化細菌の活性低下もおこり、発生したアンモニアの硝化作用が阻害されます(図-3参照)。但し、活性低下によりアンモニアが増加する可能性がありますが、pHが低い時はアンモニア態窒素のうちNH4+(解離アンモニウムイオン:イオンになっている)の割合が増え、毒性の強いNH3(非解離アンモニア)割合が減少し、魚に対する毒性は弱められます。
4.飼育水槽水質例
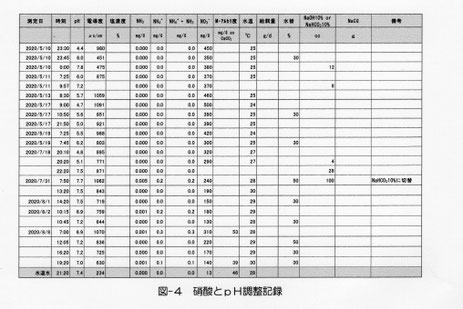
実際の飼育水槽では硝酸濃度が450mg/ℓまでなり、pHが4.4まで下がりました。水替えやpH調整剤(NaOH10%)でpH調整を実施しましたが、pHの変動が大きく、pH調整剤をNaHCO310%(重曹)に変えアルカリ度で管理することにより、pH変動を抑えることができるようになりました(図-4)。
5.水替え頻度とフィルター
1)水替え頻度
魚は人間と同じで、餌を食べるとアンモニアを出します(糞尿)。アンモニア(非解離性)は魚には有害で、 少量でも死んだり成長が止まります。しかし酸素が十分あると、水中やろ過器にいる硝化菌の働きで硝酸に変わります(硝化)。硝酸は魚にはある程度の濃度までは影響ありません(繁殖限界濃度は30mg/ℓ、健康限界濃度は00mg/ℓ)。硝酸ができるので繁殖限界濃度でpH=5程度まで下がりますが、魚は低pHでも育ちますが、硝化を行う硝化バクテリアは低pHに弱いので、水のpHは6程度以上に保つ必要があります。健康な魚は魚体重1g当.002g/日の硝酸を出しますので、魚体重が50gとすると、0.1g/日の硝酸を 水中に排出します。40ℓの水槽では、硝酸の限界濃度は40ℓ×30mg/ℓ÷1000=1.2gになり1.2g÷ 0.1g/日=12日で、硝酸の健康限界濃度になります。硝酸の濃度を下げるには水換えが一番手っ取り早いですが、一度に水換えすると、環境が急変し魚に悪影響を及ぼすので、一週間に1/3程度ずつがベターです。したがって魚を元気に大きく育てるには、①十分な酸素供給(ブクブク)と②水換えが必要です。水槽はセット直後は、水中やろ過器の硝化バクテリアが少ないのでアンモニア濃度を下げるために水換えを頻繁に行いますると出すアンモニアも増えるので硝化菌量も増やすために外部フィルターの増設をお推めします。又、酸素は魚も消費しますが、硝化菌も好気性のため酸素を多量に消費しますので、酸素をある状態(好気状態)に保つため、エアーポンプによる給気は必要です。
2)フィルターの役目
フィルターの役割は、濁りの除去と考えがちですが、趣味のアクアリウムでは主に生物ろ過の役割がメインです。魚が出す排泄物に含まれるアンモニアを硝化してくれる、アンモニアのフィルターです。アンモニア(非イオン性)は少しでもあると魚には有害ですが、硝化でできた硝酸も、アンモニアほど有害ではありませんが、多いと魚の健康を害します。硝酸の健康限界濃度は100mg/ℓ(致死濃度は500mg/ℓ程度)と言われています。健康な魚は魚体重1g当り0.002g/日の硝酸(排出アンモニア相当)を出します。
硝酸の限界量は40ℓ×100mg/ℓ÷1000=4gになり、4g÷0.1g/日=40日で限界濃度に達します。硝酸の濃度を下げるには脱窒法などいろいろありますが、中途半端な処理では、硝化細菌がアンモニアを硝酸まで硝化(酸化)した硝酸が、脱窒素細菌により窒素までならず(脱窒:還元)、途中の毒性のある亜硝酸にとどまることがあり、魚に悪影響を与えます。水道水には硝酸はほとんど含まれていませんので、硝酸濃度を下げるには、水換えが一番手っ取り早く安くつくと思います。但し、内陸の水族館や陸上養殖では新鮮な海水を得ることが難しいので、管理された脱窒装置で硝酸の除去が行われる場合があります。
魚に悪影響を及ぼすので、1/3程度ずつがベターですので、1回/10日程度が良いと思われます。又、試算した水槽では1か月に一度程度は水換えが必要と思われますが、一度に水換えすると環境が急変しフィルターは使っていくと前記のような微生物が繁殖し詰まっていき水の通りが悪くなるので。4カ月に一回程度にろ材を洗いその汚れを除去します。その際は、水道水には殺菌剤の遊離残留塩素が含まれるので、水道水で洗うとフィルターに繁殖している有益なバクテリア類が死んでしいます、ハイポなどを使い脱遊離塩素した水ですすぎ洗い程度で済ませ、もちろん洗剤の使用は禁じ手です。又、バクテリ量を急に減らさないため、水替えとフィルターの洗浄は同時に実施しないでください。
6.Mアルカリ度
アンモニアが水中の細菌類で硝化され硝酸に変わっていくと、飼育水に硝酸がたまってpHが下がっていきま
す。その時、同じ硝酸の発生量にも関わらずpHの下がり方が遅いことがあります(図―4参照)。これは水中に硝
酸ような酸が発生すると、水中に含まれるアルカリ成分が反応し瞬く間に中和されるので、pHを測ってみると変
わらない現象のためです。したがってこのアルカリ成分が多いと、硝酸化が起こってもpHの変化があまり生じま
せん。このアルカリ成分の量をアルカリ度といいます。アルカリ度の分析は水に強酸(硫酸)を加えて、pH値が
4.8に中和するのに必要な酸の量を表しますが、この方法で測定した値をMアルカリ度と呼びます。これはサンプ
ル水にあらかじめメチルレッドという色素成分を添加すると黄色に着色されますが、硫酸を加えてpHが下がり
pH=4.8になると黄色から赤色に変ります。この変色点を硫酸の添加の終点とします。水中のアルカリ成分が多
いと硫酸の添加量が多くなります。この硫酸の添加量がアルカリ度の数値として表します。Mアルカリ度のMは
メチルレッド(methyl red)の頭文字のMからきています。Mアルカリ度の値は、分析時に添加した硫酸の量を
炭酸カルシウム(CaCO3)の濃度で換算し表します。アルカリ度は2種に区別され、pH8.3まで中和した場合の
酸消費量をフェノールフタレインアルカリ度(Pアルカリ度)、pH4.8までの酸消費量を総アルカリ度(Mアルカ
リ度)と呼んでいますが、自然水はpHが8.3になることがないので、Pアルカリ度は常に0になります。自然水
のアルカリ成分は炭酸カルシウムなどの炭酸塩又は炭酸水素塩が主な成分です。雨水中に溶けているCO2や土壌中
の生物の呼吸作用、地下水が石灰岩のような堆積岩(炭酸塩)を通過するとき、炭酸水素塩としてCa、Mg等を溶
出してくることに起因しています。
7. 水の大循環
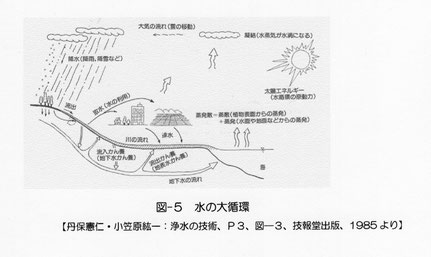
水槽の水は水道水ですが、水道水は浄水場で河川水(表流水、伏流水)や地下水を浄化して供給されています(SKSの仕事?)。河川水や地下水は雨が地上に降ってきてできます。雨は海の水が蒸発し雲になりそれがみなもとですが、海の水は川から流れてきた水です。このように、地球上の水は循環してなくなることはありません(図―5)

8.雨水
地下水はアルカリ度が高く30~80mg/Lで、表流水は通常20~40mg/L、河川水は一般に上流は低く、下流に行くほど少しずつ増加するといわれています。自然水中のアルカリ度の成分は、炭酸カルシウムや炭酸水素カルシウム(重炭酸)が主成分です。(そのほかに遊離の水酸化物、量的にはわずかですが、ケイ酸、リン酸、ホウ酸などがあります。炭酸カルシウムや炭酸水素カルシウム濃度を炭酸塩濃度といいます)。もともと地下水や河川水は、海から蒸発した水が地上に降ってきた雨水ですが、蒸発した時は何も溶けていませんが、海から蒸発した水には最初何も溶けていませんが、空気中で酸素や窒素、炭酸ガスが溶け込みます。炭酸ガスが溶け込むと炭酸ができてpHが下がりますpH=5.6~5.7)。地上に降ってきた後に地中に通り、井戸水や河川に流れだします。

9.アルカリ度の正体
地中には石灰岩(炭酸カルシウムを多く含む岩)が多く存在し、酸性の地下水が地中を通過するときに石灰岩が溶け込みます。溶け込む量は地下水が石灰岩に接触している時間が長いほど多くなるので、地下水や河川の下流の炭酸塩濃度(Mアルカリ度)は高くなります(図-7)。 自然水中のアルカリ分は主に地質(特に石灰岩)から供給される成分ですから、アルカリ度は地質条件を推定するうえでよい指標となります。また下水や工場排水の影響を受けると著しく増減するので、水質汚濁の指標にもなります。また、浄水に使われる薬費品(凝集剤)が水のpHを下げる効果があるので、一定のアルカリ分を必要とすることから、浄水処理においてもアルカリ度は重要な指標となります。水のMアルカリ度が高いということはpHの低下に対する抵抗力が大きいということですが、重炭酸塩を含む水のpHは高くありません。(重炭酸塩のpHは8.4程度までにしか上がらない:図-5参照)。Mアルカリ度の低い水の20㎎/l程度以下)は一般に腐食性が強く、金属やコンクリート構造物を劣化させるといわれています。日本の一般の水道水のMアルカリ度は50前後です。
10.Mアルカリ度の測定方法
Mアルカリ度はpH値が4.8まで下がるまでの酸の消費量ですが、pH値の判定は、pHメーターまたはpH指示薬で測定します。JIS K0102ではpH8.3アルカリ度とpH4.8アルカリ度が採用されています。pH8.3アルカリ度は指示薬としてフェノールフタレイン(phenol-phthalein)およびその混合指示薬を使うことからPアルカリ度と呼ばれます。Pアルカリ度はアルカリ成分のうち水酸イオン(OH-)と炭酸イオン(CO32-)の量に対応します。pH4.8のMアルカリ度の指示薬としてMR(methylred)指示薬使うことからMアルカリ度と呼ばれます。Mアルカリ度は、水中のアルカリ分の総量という意味で総アルカリ度とも呼ばれます。通常の河川水はほぼ中性(pH7)ですからPアルカリ度は0です。地下水の主な成分は重炭酸塩なので、Mアルカリ度から重炭酸イオン(HCO3-)の量を次式によって概算することができます。
Mアルカリ度(CaCO3㎎/l)=重炭酸イオン(㎎/l)×50/61
重炭酸イオンは、水中では炭酸カルシウムや炭酸マグネシウムがイオン化した陰イオンですが、カルシウムや マグネシウムの 硬度成分(一時硬度)と対で存在しますので、Mアルカリ度を測定し、カルシウムやマグネシウムの硬度成分の量を推定するこ とができます。一般的にはMアルカリ度の測定は、酸の滴定量で測定でき、非常に簡単に測定できますが、カルシウムやマグネ シウムの精密な測定は難しいので、Mアルカリ度から推定することがよく行われます。水草アクアリウムの世界では水草の生育 に硬度の指標が重要視されることから、KH(炭酸塩硬度)が測定されますが、これは重炭酸イオンの量を測定し、その測定値 を硬度として換算し表現した値として、飼育現場では簡易的に使用されることがあります。
KH硬度(dH)=重炭酸イオン(CaCO3㎎/l)×0.056

11 海水
地球の表面積の約70%は、海水に覆われています。その量は約140京tで、地球上に存在する水分のおよそ97%を占めていまします。そもそも海水がどのように誕生したのかには、さまざまな仮説があります。一般的には、46億年前の地球の形成期、小惑星が次々に激突と合体を繰り返して原始地球を形成した後、地球内部の含水物質の水分が熱エネルギーによって蒸発し地表に現れました。これが地表温度の冷却とともに凝縮されて水となり、地殻内に溜まることで、原始海水が生成されたと考えられています。
この時期、つまり今から45億年ほど前の海水は、現在のような塩辛い水ではなく、酸っぱい水であったと考えられています。当時、地表から噴出した多量のガスには水素や塩素、水蒸気などが含まれていました。なかでも塩素ガスは水に溶けやすい性質をもっており、雨と一緒になって塩酸の雨として地表に降り、海に溶け込んでいきました。このため当時の海水は強い酸性を示すいわば塩酸の海でありました。その後、長い年月の経過とともに、海中の岩石に含まれるカルシウムや鉄が溶け出し、これらが海水に混じることによって、次第に海水は酸性から中性に変化し、現在のような塩辛い海水となりました。
海水は、96.6%ほどの水と約3.4%の塩分で構成されています。つまり1リットルの海水には、34gほどの塩が含まれていることになります。では、この塩の成分をさらに分類すると、いわゆる食塩と呼ばれる塩化ナトリウム(NaCl)が77.9%と、その大部分を占めている。以下、順に塩化マグネシウム(MgCl2)が9.6%、硫酸マグネシウム(MgSO4)6.1%、硫酸カルシウム(CaSO4)4.0%、塩化カリウム(KCl)2.1%、その他0.3%となります。
ところで、よく「海水の塩分比率は生物の体液と近い」と言われることがありますが、生体の塩分濃度は約0.9%であり、海水の約3.4%に比べるとはるかに低い。ただし、海水の塩分濃度は、地球という惑星の長い歴史のなかで少しずつ濃度を増しており、原始海水は現在の海水よりもカリウム濃度が高かった。このため生体の細胞質基質の電解質組成は、地球に生命が誕生した当時の海水に近いものと考えられています。また、細胞外液の組成は、浸透圧が低くナトリウムの比率が高くなっており、これは生命が海から陸上に生活圏を広げた時代の海水に近いと言われています。つまり現在の海水の塩分比率こそ、生物の体液の塩分比率とは異なるが、生物の細胞質基質や細胞外液などは、太古の海水の組成を今に伝えているともいえます。
